APPLICATION
生物组织由细胞构成,而细胞由蛋白质、核酸、脂肪等拉曼信号较强的基本物质构成。疾病的产生往往伴随组织和细胞的恶变,*早体现在蛋白质、核酸、脂肪等基本构成物分子结构构象或数量上的变化,但疾病初期这些变化的临床症状和医学影像表现往往并不明显,因此对于初期症状不太明显的病症检测仍需要寻求一些其他的技术手段和方法来实现早期诊断!
拿肿瘤检测举例,肿瘤的三种主要检测方法为肿瘤标志检测、组织病理学诊断和影像学诊断[]。肿瘤标志物检测易受个体差异以及某些良性疾病的影响,一般只能作为辅助手段;组织病理学诊断是肿瘤诊断临床应用上的“金标准”,该方法从组织和细胞尺度上进行肿瘤 的诊断。组织病理学是一门非常复杂的学科,要求检测人员具有丰富 的经验,对检测人员的专业性要求较高,且诊断的时效差,属于有创的诊断方式。影像学诊断一般借助荧光成像或者其他显微成像技术,会引入外部标记物,可能无法反应正常的细胞环境。
拉曼光谱是一种分子诊断技术,在生物分子水平上显示出组织病理学评估的前景,在过去的20年中,通过全面的体外研究,拉曼光谱的准确诊断能力已经积累了大量的证据。
拉曼光谱具有以下优势:
高特异性: 拉曼光谱对分子的特异性非常高,可以准确识别不同生物分子,有助于对肿瘤组织和正常组织进行区分。传统的基于拉曼光谱的肿瘤诊断方法有体内诊断和体外诊断。体外诊断通常采集肿瘤组织或癌细胞系、血液或血液成分、肿瘤标志物(CTC)等原材料进行拉曼光谱数据的采集,采集到的数据多采用主成分分析-线性判别分析(PCA-LDA)等多变量统计分析方法来分析,着力寻找正常样本以及不同分期的癌变样本之间的光谱差异,从而实现对不同肿瘤的诊断,根据文献报道,已经可以通过拉曼光谱诊断出不通过部位的恶性肿瘤(癌症),如膀胱癌,脑癌、肺癌、食管癌等;但是这种光谱差异往往不是很明显,只通过操作人员的经验很难进行肿瘤的分期判别;人工智能的机器学习算法引入,通过大量的数据训练,让算法自动寻找差异并且判别是未来发展的趋势。常规的体外诊断一般可以采用显微共焦拉曼来进行测试,根据样品的不同选择合适的激发波长即可。
相比于体外诊断,利用拉曼探头进行体内诊断的难度更大;主要体现在:
1、体内环境比较复杂,对探头的要求较高,需要一定的耐腐蚀设计;虽然困难重重,但是科研人员依旧取得了不错的进展。
案例1:巴雷特食管是食管腺癌的前兆,早期识别异型增生等高危病变对于提高患者生存率至关重要。用于诊断BE异型增生的传统内窥镜检查受到诊断准确性差和需要大量活检取样的限制,导致高昂的医疗成本和患者负担。在新加坡进行的研究涉及从373名具有不同组织学亚型的上消化道患者身上获取体内组织拉曼光谱,从而构建了一个用于诊断BE异型增生的综合拉曼库,该系统允许在内窥镜检查期间进行实时、无创或微创光学活检,以更高的精度针对高风险组织区域[]。
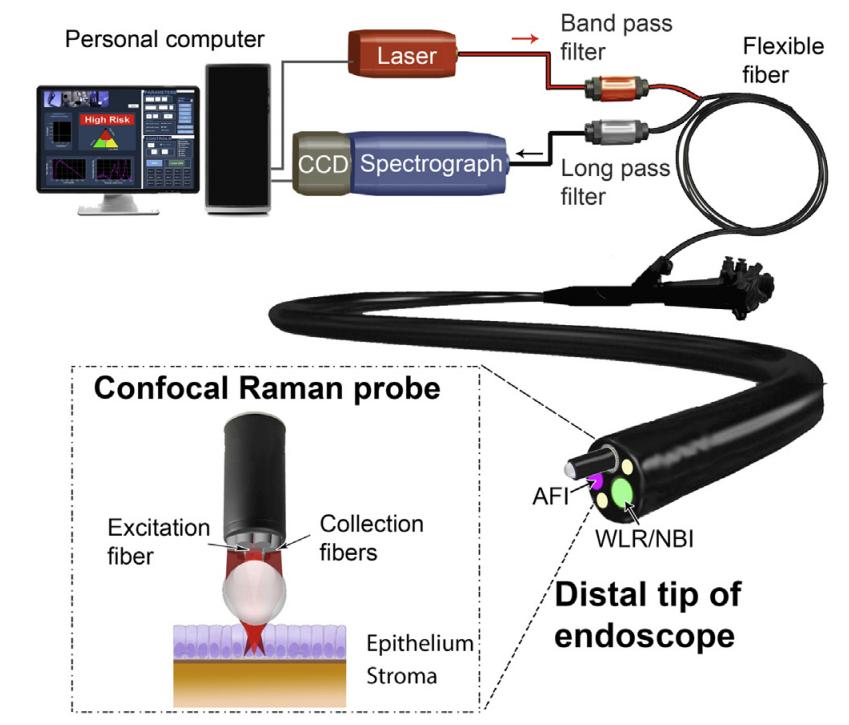
图1 实验装置示意图
案例2:炎症性肠病(IBD)影响着全球大量个体,区分溃疡性结肠炎 (UC) 和克罗恩病 (CD) 缺乏金标准。研究人员介绍了一项使用拉曼光谱对炎症性肠病 (IBD) 进行临床表征的研究,重点关注溃疡性结肠炎 (UC) 和克罗恩病 (CD)。使用基于结肠镜耦合光纤探针的拉曼光谱进行了一项体内研究,以识别UC和CD的光谱特征。通过使用统计技术分析收集到的光谱,他们开发了一种预测算法,在区分CD方面实现了90%的灵敏度和75%的特异性[]。
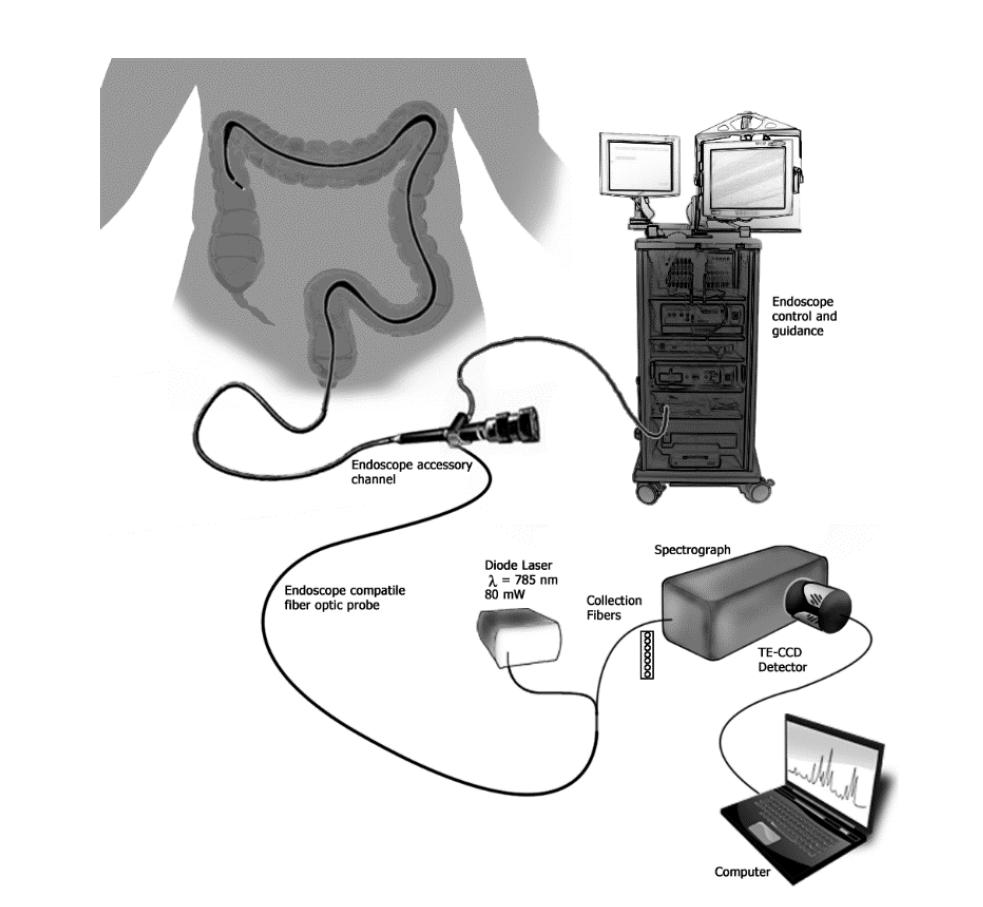
图2 实验装置示意图
案例3:如果在手术过程中没有检测到所有的癌细胞,手术作为-种癌症治疗的有效性就会降低,从而导致复发,对生存产生负面影响。为了在癌症手术中*大限度地检测癌细胞,研究人员设计了一种术中原位、无标记、光学癌症检测系统,该系统结合了固有荧光光谱、漫反射光谱和拉曼光谱。使用这种多模态光学癌症检测系统,我们发现脑癌、肺癌、结肠癌和皮肤癌可以在手术中原位检测,其准确性、灵敏度和特异性分别为97%、100%和93%。这种高灵敏度的光学分子成像方法可以深刻地影响广泛的外科和无创介入肿瘤学的范围程序,通过提高癌症检测能力,从而减轻癌症负担,提高生存率和质量生活[]。
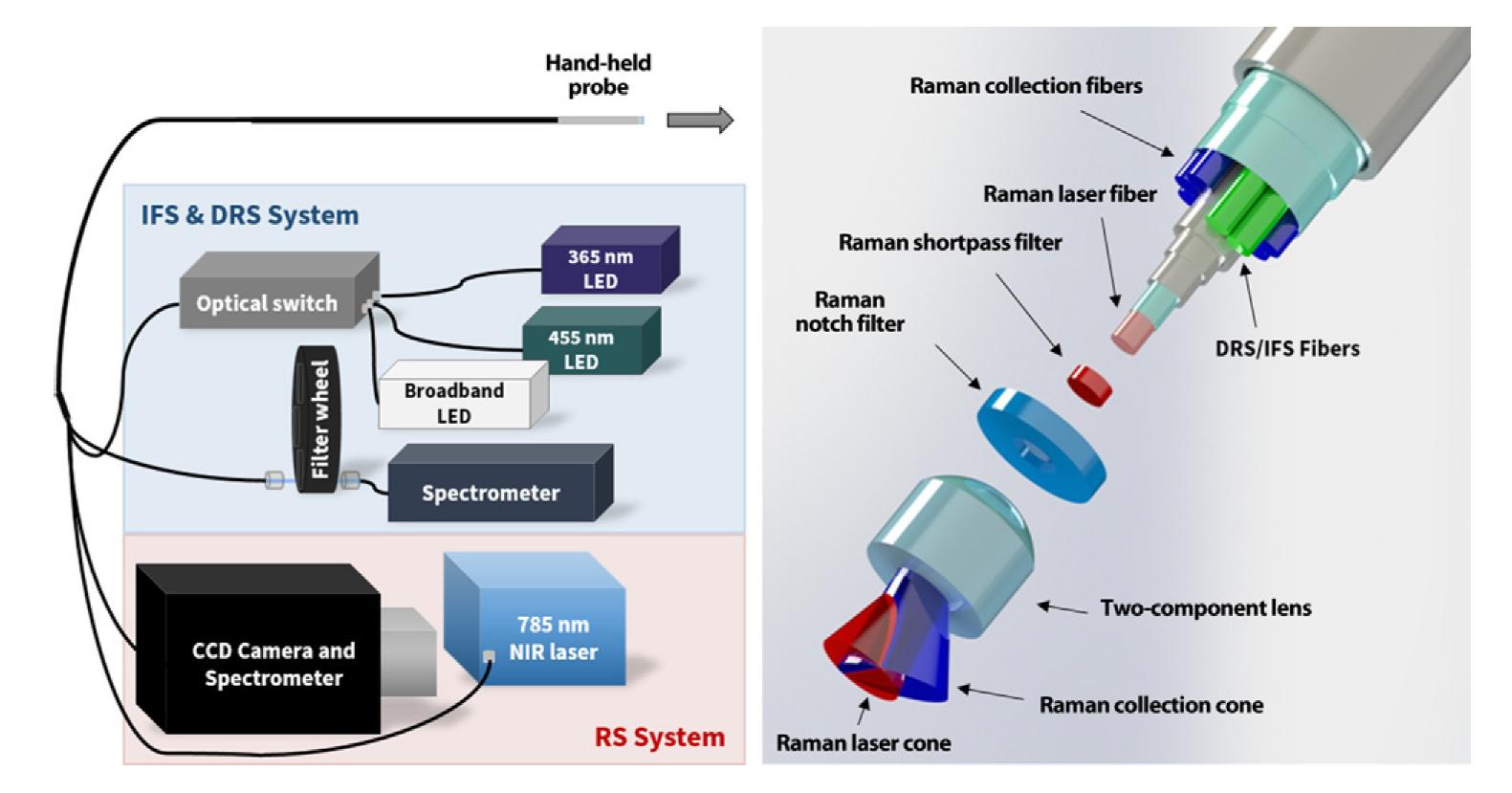
图3 多模态光谱检测系统
卓立汉光可以提供体外显微共聚焦拉曼光谱仪, 也能提供医用内窥拉曼光谱仪。
显微共聚焦拉曼光谱仪 finder930
Finder930全自动化拉曼光谱仪在卓立经典的共聚焦拉曼光谱仪的基础上,新增了多种全新技术,非常适用于体外的组织拉曼成像诊断测试。:
1、采用针孔共聚焦设计,空间分辨达到500nm,轴向分辨<1um,极大程度抑制了非共聚焦点外的荧光或者其他背景干扰;医用内窥拉曼光谱仪

医用拉曼光谱仪基于我们代理的EMVISION 的内窥拉曼探头,结合自主研发的透射光谱仪和科研级制冷型CCD,超大的光通量可以保证尽可能的信号损失,超高的灵敏度可以保证极高的信噪比,光纤耦合,易于与内窥镜结合使用。
|
拉曼光谱仪 |
光谱仪结构:VPH透射光栅光谱仪 激光激发波长:785 nm 拉曼频移范围:350 cm-1 to 2,400 cm-1 光谱仪入口狭缝:10um-6mm可调 光谱仪F/#通光口径:f/2.3 光谱仪分辨率:优于5cm-1 光谱仪接口:SMA/MPO/10mm圆柱 |
|
光谱CCD |
具有高像元分辨率的CCD芯片,分辨率≥2000x256 可见近红外拉曼专用CCD,量子效率在700nm-870nm区间处>90%, 深制冷温度至-60C 读出噪声< 5电子/像元 |
|
光纤拉曼探头 |
高灵敏度光纤探头(内窥版本) Y型光纤,分为激光端,光谱仪端和样品端。医用尼龙包层,可直接用于皮肤,脑组织等生物样品拉曼检测。 激光端:FC/PC光纤接口,300um芯径光纤,单芯 光谱仪端:**Snap-in即插即用接口,300um芯径光纤,6芯,排成一行 样品端:探头尾部直径<2.1mm,金属部分长度6.5mm 样品端包含785的干涉滤光片,785的高通滤光片,微透镜,焦距500um 光纤总长度3米 |
|
光纤拉曼探头 |
高灵敏度光纤探头(非内窥版本) Y型光纤,分为激光端,光谱仪端和样品端。医用尼龙包层,可直接用于皮肤,脑组织等生物样品拉曼检测。 激光端:FC/PC光纤接口,300um芯径光纤,单芯 光谱仪端:**即插即用接口,300um芯径光纤,6芯,排成一行样品端:手持部分约 100mm,探头尾部直径<2.1mm。 样品端包含 785 的干涉滤光片,785 的高通滤光片,微透镜,焦距 500um。 光纤总长度3米 |
|
激光器 |
光纤激光器,785nm,350mW,FC-PC接口,<0.15nm带宽, |
Finder Insight Pro 系列小型激光拉曼光谱仪
Finder Insight Pro 系列小型激光拉曼光谱仪是经过性能优化的一款小型化的研究级拉曼光谱仪,它采用了科研级高灵敏度检测器和大通光量的分光系统,可选配96孔测试板,配合软件进行全自动测量操作。
1、单点测量与顺序测量,单谱采集、连续采集、间隔采集等模式,用户自由选择;
参考文献:
免责声明
北京卓立汉光仪器有限公司公众号所发布内容(含图片)来源于原作者提供或原文授权转载。文章版权、数据及所述观点归原作者原出处所有,北京卓立汉光仪器有限公司发布及转载目的在于传递更多信息及用于网络分享。
如果您认为本文存在侵权之处,请与我们联系,会一时间及时处理。我们力求数据严谨准确,如有任何疑问,敬请读者不吝赐教。我们也热忱欢迎您投稿并发表您的观点和见解。
Copyright © 2020 Zolix .All Rights Reserved 地址:北京市通州区中关村科技园区通州园金桥科技产业基地环科中路16号68号楼B.
ICP备案号:京ICP备05015148号-1
公安备案号:京公网安备11011202003795号

 13810146393
13810146393 在线咨询
在线咨询