APPLICATION
引言
γH2AX 是染色体组蛋白H2A家族的成员之一。在各种理化因素刺激下,细胞DNA双链发生断裂,ATM、ATR等磷脂酰肌醇3-激酶使H2AX上的第139位丝氨酸发生磷酸化修饰,形成磷酸化的γH2AX 。γH2AX作为一种生物标志物可以清楚地反映DNA损伤程度和修复情况, 被国内外广泛应用于细胞凋亡研究中, 是细胞损伤应激反应的研究热点之一。常见的γH2AX鉴定分析方法包括免疫发光法和质谱法,但因复杂预处理过程会假阳性。因此原位实时检测细胞核内γH2AX对于准确评估遗传毒性至关重要。SERS技术具备原位、无损、预处理简单、高灵敏度等优势,有望用于γH2AX原位分析。但是,SERS检测细胞核内物质仍面临巨大挑战。SERS增强效果与粗糙金属尺寸相关,颗粒直径越大,振荡频率和增强效果越好。进入细胞核内需要穿过核孔,其限制直径尺寸为10-30nm,粗糙金属颗粒尺寸小导致SERS增强效果弱。在现有技术中,主要通过修改核定位序列实现主动运输至细胞核来实现核内检测,该技术提高了进核效率,却因基质存在而产生背景干扰。
在本文中,南京师范大学王琛教授课题组构建了一种基于金纳米粒子(GNPs)的小型免疫传感器SERS探针,成功检测受限靶点γH2AX,评估药物遗传毒性。作者利用γH2AX作为限制靶点的特性,构建了一种基于小尺寸(15nm)金纳米探针的γH2AX免疫传感器,并用TAT核靶向肽对其进行了修饰,以确保高的核进入效率。一旦DNA损伤被诱导,γH2AX的局部过表达通过免疫识别进一步募集探针,从而可以原位组装热点,将增强拉曼信号用于遗传毒性检测。本研究提出了一种研究提出了一种新的SERS检测受限靶诱导的尺寸转换和热点形成的方法,用于分析核内遗传毒性标志物。该技术的优点在于简化了SERS探针的结构和操作过程,避免了对含有热点的系统的额外设计,从而减少了背景信号,从而为在单个活细胞水平上原位实时检测核内靶标提供了参考。
结果分析
作者利用γH2AX作为限制靶点的特性,构建了一种基于小尺寸(15nm)金纳米探针的γH2AX免疫传感器,探针以4-巯基苄腈(4-MBN)修饰的15nm GNPs为增强颗粒,PEG2000为稳定链,TAT为穿透肽,γH2AX单克隆抗体为探测识别物,建立为抗-γH2AX@GPMT的SERS传感器。
实验时通过TAT穿透肽的小颗粒和核靶向功能进入细胞核,将构建的SERS细胞传感器与药物一起孵育。若药物没有遗传毒性探针以分散状态分布,拉曼信号弱。相反,如果药物具有遗传毒性发生DNA损伤,产生γH2AX的局部表达,诱导探针进一步免疫识别和聚集,在原位构建增强热点,产生高强度拉曼信号实现遗传毒性鉴定。
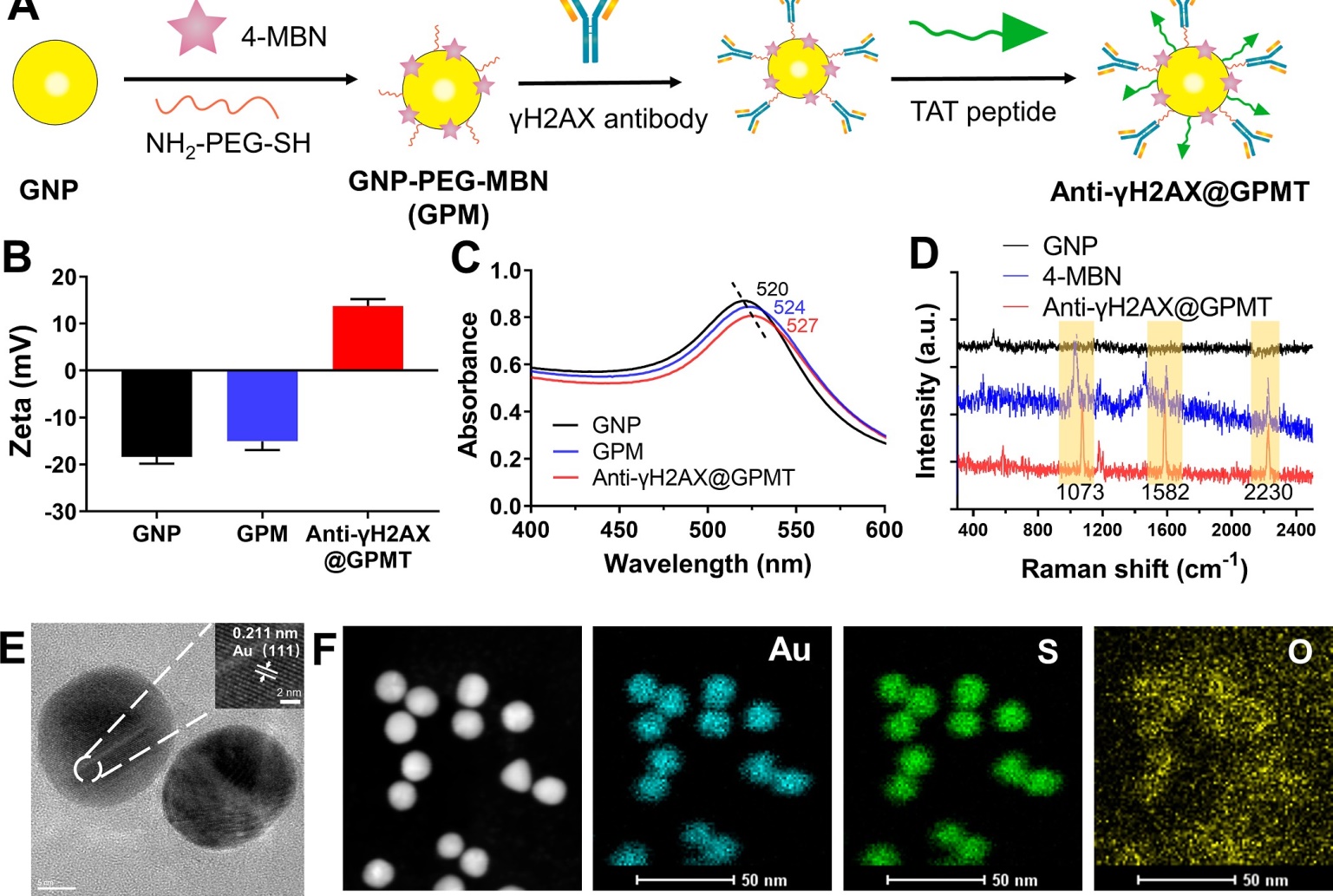
图1 (A)抗-γH2AX@GPMT制备原理图;(B) GNPs的ζ电势图;(C)不同GNPs紫外-可见光谱图;(D)不同基质拉曼光谱图(1592cm-1和2230 cm-1是4-MBN特征峰);(E)抗-γH2AX@GPMT的TEM图像;(F) anti-γH2AX@GPMT的EDX图
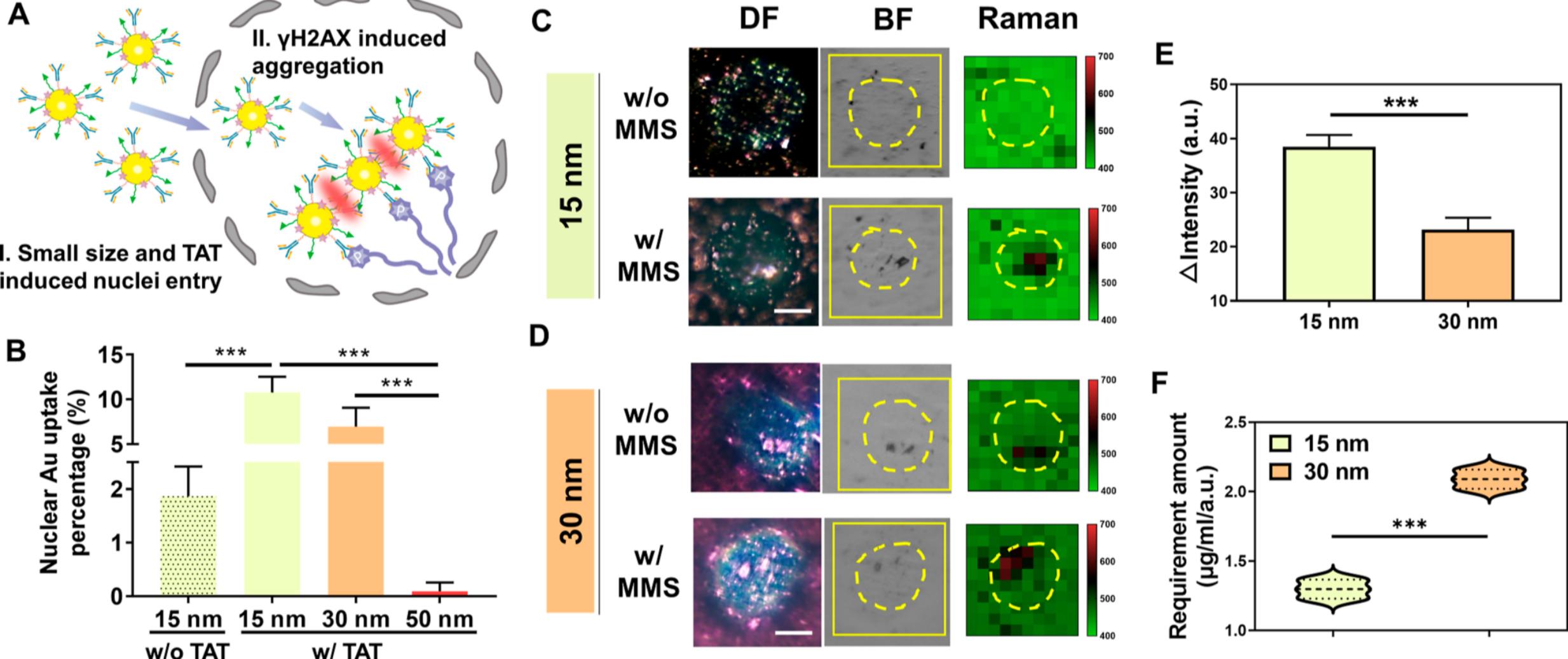
图2 (A)抗-γH2AX@GPMT的检测策略.(B)TAT修饰不同尺寸SERS基底Au尺寸分布(C)15nm抗-γH2AX@GPMT在2230 cm−1处的暗场、明场和拉曼光谱图(D)30 nm抗-γH2AX@GPMT在2230 cm−1处的暗场、明场和拉曼光谱图(E)MMS孵育前后SERS强度差值。(F)抗-γH2AX@GPMT的MMS平均需求量
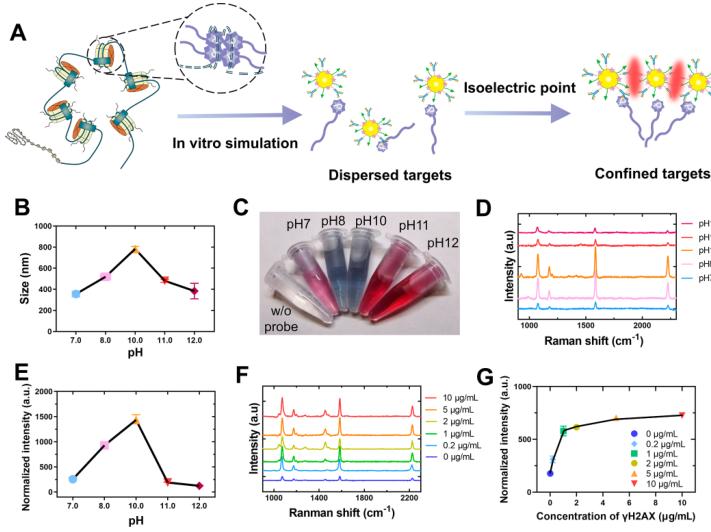
图3 (A)γH2AX靶点体外模拟方案略.(B) γH2AX尺寸与PH值关系(C)加入抗-γH2AX@GPMT.后实物图(D)不同PH值孵育环境下,抗-γH2AX@GPMT的拉曼光谱。(E) 抗-γH2AX@GPMT在2230cm-1拉曼强度与PH值关系。(F) 不同浓度的γH2AX肽孵育的抗-γH2AX@GPMT的拉曼光谱图(G)抗-γH2AX@GPMT在2230cm-1拉曼强度与γH2AX肽浓度关系
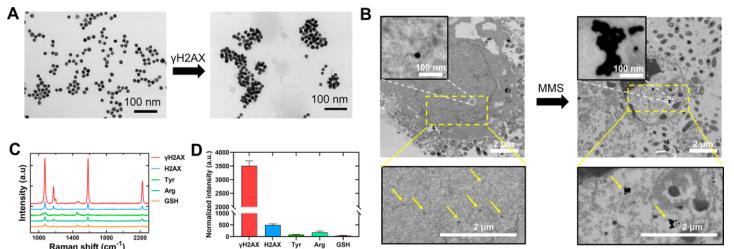
图4 抗-γH2AX@GPMT的靶诱导机制.(A)加入γH2AX肽前后抗-γH2AX@GPMT的TEM图像(B) 抗γ的生物TEM图像H2AX@GPMTγH2AX孵育前后。(C)抗-γH2AX@GPMT拉曼光谱(D)抗-γH2AX@GPMT的2230 cm−1拉曼光谱归一化强度
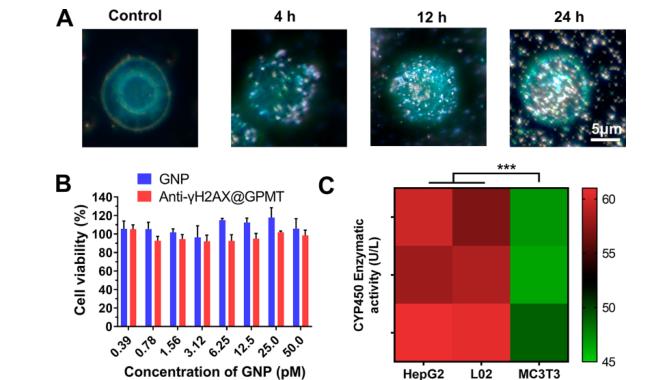
图5 SERS传感器优化和表征。(A)不同时间下细胞摄取抗-γH2AX@GPMT显微图像(B) 加入GNP和抗-γH2AX@GPMT后L02细胞活性(C)不同传感器的CYP450代谢酶活性。
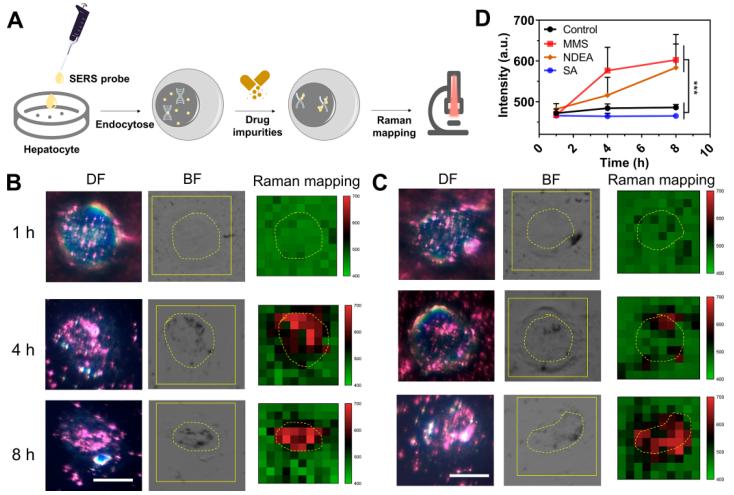
图6(A)药物遗传毒性评价方案。(B) 在不同时间MMS孵育时间细胞暗场、明场和拉曼Mapping图(2230 cm−1峰位)。黄色实线区域为拉曼采集区。黄色虚线圆圈表示细胞核区域(C)在不同时间MMS孵育时间细胞暗场、明场和拉曼Mapping图(2230 cm−1峰位)。(D) 不同孵育时间下2230 cm−1的拉曼平均强度
结论
本研究以γH2AX为细胞核内定向靶点,突破了SERS探针进入细胞核效率和信号增强因子之间的局限性。构建了一种基于GNP探针的γH2AX免疫传感器来评估药物遗传毒性。该传感器具备TAT膜穿透性和核靶向功能,使小颗粒探针能够穿过核孔并成功进入细胞核。该探针进入细胞核内后,GTIs诱导DNA损伤和γH2AX局部过表达,导致原位构建增强热点并产生强拉曼信号,进一步增强了探针的免疫识别性能,解决了小探针增强性能差和大探针入核效率差的矛盾难题。本文所设计SERS探针可原位分析细胞核内遗传毒性,为药物遗传毒性筛选提供了一种新方法,也为细胞核内原位实时检测提供了实验灵感。
南京师范大学王琛教授课题组简介
王琛,南京师范大学化学与材料科学学院教授,博士生导师,国家**青年科学基金获得者(2020年),江苏省“青蓝工程”**青年骨干教师、中青年学术带头人,南京师范大学中青年领军人才;南京师范大学本科、硕士,2011年博士毕业于南京大学化学化工学院生命分析国家重点实验室,2012-2016南京大学从事物理学博士后,2016-2017年麻省理工学院(MIT,美国)访问学者。至今,在Angew. Chem. Int. Ed., Sci. China Chem., Nano lett., ACS Nano, Anal. Chem.等学术期刊发表研究论文60 余篇;参编英文图书 《Nanobiosensors: From Design to Applications》(Wiley);主持多项国家自然科学基金、江苏省重点研发、江苏省自然科学基金等项目;担任Chinese Chemical Letters期刊编委,中国分析测试协会青年学术委员会委员,江苏省材料学会副秘书长。
文章信息
本文以“Confined Target-Triggered Hot Spots for In Situ SERS Analysis of Intranuclear Genotoxic Markers”为题发表在Analytical Chemistry上,中国药科大学韩凌飞为*一作者,南京师范大学王琛教授和中国药科大学柳文媛教授为通讯作者。
本研究采用的是北京卓立汉光仪器有限公司RTS2 多功能激光共聚焦显微拉曼光谱仪,如需了解该产品,欢迎咨询。

免责说明
北京卓立汉光仪器有限公司公众号所发布内容(含图片)来源于原作者提供或原文授权转载。文章版权、数据及所述观点归原作者原出处所有,北京卓立汉光仪器有限公司发布及转载目的在于传递更多信息及用于网络分享。
如果您认为本文存在侵权之处,请与我们联系,会*一时间及时处理。我们力求数据严谨准确,如有任何疑问,敬请读者不吝赐教。我们也热忱欢迎您投稿并发表您的观点和见解。
Copyright © 2020 Zolix .All Rights Reserved 地址:北京市通州区中关村科技园区通州园金桥科技产业基地环科中路16号68号楼B.
ICP备案号:京ICP备05015148号-1
公安备案号:京公网安备11011202003795号

 13810146393
13810146393 在线咨询
在线咨询